Presentazione e contestualizzazione dell’attività
L’esperienza che presento qui è adatta a vari tipi di scuola e vari livelli. L’esercitazione ha l’obbiettivo di insegnare partendo dall’esperienza, imparando a dedurre dalle evidenze, ad inferire e a progettare un esperimento per testare le proprie ipotesi.
L’argomento di questa lezione sono le reazioni chimiche e in particolare capire come possono reagire due sostanze e scoprire che il risultato di una reazione può essere la chiave per identificare una sostanza ignota.
L’attività così come è descritta in questo articolo richiede circa due ore.
L’esperimento può anche essere portato ad un più alto livello di complessità aggiungendo un passaggio di quantificazione dell’aspirina allo spettrofotometro utilizzando la stessa reazione colorimetrica che in questo protocollo viene proposta per l’identificazione. In questo secondo caso, l’esperienza dà lo spunto per parlare dell’effetto della concentrazione e della quantità di una sostanze ingerita sulla sua azione farmacologica e sulla sua tossicità.
Il mistero sul quale gli studenti devono indagare può essere presentato in vario modo a gusto dell’insegnante.
In questa pagina troverete:
-
-
- il protocollo per preparare l’esperimento o guida per l’esercitatore
- il protocollo per eseguire l’esperimento (anche scaricabile in pdf)
- un foglio guida sul quale gli studenti annotano le proprie osservazioni (anche scaricabile in pdf)
- alcune immagini dei risultati attesi
- qualche indicazione su dove acquistare il materiale e sul costo indicativo dell’esperienza
- alcune utili referenze
-
Preparazione del materiale:
- Piastre per le reazioni 3 per gruppo di lavoro -> piastre da coltura con 12 pozzetti
- Misurini piccoli (ad esempio tappi dei tubini da PCR)
- Beker in plastica grandi per gli scarti liquidi almeno uno per gruppo
- Stecchini in plastica da caffè usa e getta per mescolare (almeno 15 per gruppo)
- Pipette tipo Pasteur in plastica monuoso (5-10 per gruppo)
- Pennarelli indelebili almeno 1 per gruppo
- Tubi in plastica per le soluzioni (tipo falkon da 15 ml, 5 per gruppo; tipo falkon da 50 ml, 1 per gruppo) e le sostanze (tipo bijoux, 5 per gruppo; contenitore per i campioni raccolti sulla scena dell’investigazione abbastanza per distribuire 4 campioni ignoti per gruppo)
- Aspirina in polvere, bicarbonato di sodio (NaHCO3), amido di mais o fecola, zucchero
- Soluzione 1: Acqua distillata (almeno 20 ml x 12 gruppi -> 250ml)
- Soluzione 2: Lugol I3K (150-200 ml)
- Soluzione 3: Soluzione diluita di colorante Blu bromotimolo o rosso fenolo o rosso cresolo 250ml (in questo link ci sono le referenze di coloranti con rispettivi pK, così si può scegliere fra quelli a disposizione a scuola senza comperarne uno appositamente per l’occasione: http://www.chimicamo.org/chimica-analitica/la-colorimetria-il-piu-semplice-metodo-di-analisi-in-assorbimento.html )
- Soluzione 4a: Soluzione di Idrossido di sodio (NaOH) 1M
- Peso molecolare 39.997 g/mol
- 40 grammi in un litro di soluzione; 10 g in 250ml
- Soluzione 4b: Nitrato ferrico Fe(NO3)3 0.2M
- Peso molecolare 241,86 g/mol (anidro); 349,95 g/mol (idrato con 6 H2O); 404,00 g/mol (idrato con 9 H2O)
- .. g in 250ml
Protocollo dell’esperimento da consegnare agli studenti (protocollo.pdf)
Materiale a disposizione di ogni gruppo
-
-
- 3 piastre da 12 pozzetti per le reazioni
- un pennarello indelebile a punta fine
- 15 palette in plastica monouso per mescolare
- 12 strisce di tappi con funzione di dosatore oppure spatola
- 1 spruzzetta contenente acqua distillata
- 1 becker per gli scarti
- carta per asciugare a disposizione
- 5-10 pipette tipo pasteur usa e getta (meglio se in plastica)
- 4 tubini contenenti polvere di: (A) Aspirina, (B) Bicarbonato, (F) Fecola di patate, (s) saccarosio
- Vassoietto a 4 camere con sostanze incognite marcate X, Y, W, Z
- 1 tubo da 50 ml con soluzione 1: Acqua distillata
- 1 tubo da 15 ml con soluzione 2: Lugol
- 1 tubo da 15 ml con soluzione 3: Indicatore rosso cresolo
- 1 tubo da 15 ml con soluzione 4a: Idrossido di Sodio 1M (NaOH)
- 1 tubo da 15 ml con soluzione 4b: Nitrato Ferrico 0.2M [Fe(NO3)3]
-
Premessa
La signora Maria viene visitata dalla guardia medica in seguito ad un malore. Il medico trova la signora a casa nella cucina dove fino a poco prima stava preparando dei dolcetti. La signora avverte nausea, si sente un po’ confusa e sente un forte fischio alle orecchie. Il medico si accorge che in mezzo ai prodotti per dolci sversati sul tavolo c’è anche un portapillole che è scivolato e si è aperto. Il medico vuole vederci chiaro, perché i sintomi accusati dalla signora potrebbero anche essere dovuti all’ingestione accidentale di una dose eccessiva di aspirina, farmaco che la signora assume regolarmente per fluidificare il sangue.
Incarica te, che stai seguendo il suo lavoro nell’ambito di uno stage, di verificare questa ipotesi.
Protocollo sperimentale
Ti suggerisce di vedere innanzitutto come si comportano i campioni puri di fecola di patate (F), saccarosio (S) e bicarbonato (B), preparando una piastra di controllo. Sul tavolo il contenuto dei diversi contenitori si è mescolato e questo potrebbe confondere le analisi successive. Per le tue deduzioni è di fondamentale importanza sapere come reagiscono le polveri pure.
ALLESTIMENTO DELLA PIASTRA N 1 (CONTROLLO)
Con il pennarello indelebile etichetta la piastra di reazione n.1 scrivendo a fianco delle lettere A, B, C la sigla del campione di controllo che analizzerai in quella riga: F = fecola di patate; B = bicarbonato; S = saccarosio. La piastra dovrebbe apparire come segue:

Indossa i guanti e segui le istruzioni punto per punto:
-
-
- Trasferisci una spatolata di fecola nel pozzetto A1; sciacqua la spatola con acqua deionizzata e asciugala.
- Con una nuova spatola trasferisci il bicarbonato nel pozzetto B1; sciacqua e asciuga la spatola.
- Con una nuova spatola trasferisci il saccarosio nel pozzetto C1;sciacqua e asciuga la spatola.
-
NB è importante pulire bene la spatola per evitare contaminazioni fra i campioni!
R Osserva con attenzione l’aspetto fisico di ciascuna sostanza e riporta le tue osservazioni nel foglio risposte [1].
Con il pennarello indelebile scrivi H2O su una pipetta pasteur: usa sempre questa pipetta per distribuire l’acqua distillata. Analogamente, scrivi Rosso sulla pasteur che userai per distribuire la soluzione di rosso cresolo. Segui lo schema della figura per mettere i reagenti al posto giusto:
- Trasferisci 1 mL di acqua distillata in tutti i pozzetti delle colonne 2, 3 e 4.
- Con il dosatore contagocce aggiungi 3 gocce di Lugol in tutti i pozzetti della colonna 3.
- Con la pasteur Rosso aggiungi 3 gocce di rosso cresolo in tutti i pozzetti della colonna 4.
Mescola le soluzioni facendo ruotare delicatamente la piastra.
Ora sei pronto per analizzare il comportamento delle sostanze, secondo lo schema:
Colonna 2: solubilità in acqua.
Colonna 3: presenza di amido (saggio di Lugol).
Colonna 4: comportamento acido – base.
Il tappo dosatore ti permette di trasferire la stessa quantità di materiale dentro ciascun pozzetto di reazione. Usa una striscia diversa per ogni sostanza: riempi di polvere un singolo tappo e versa con precisione la polvere in un unico pozzetto. ATTENZIONE: i risultati si confondono se la polvere finisce nel pozzetto sbagliato!
- Trasferisci la fecola di patate in tutti i pozzetti della fila A: con la paletta in plastica mescola bene la reazione nel pozzetto A2; sciacqua la paletta con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti A3 e A4.
- Trasferisci il bicarbonato in tutti i pozzetti della fila B: con la paletta in plastica mescola bene la reazione nel pozzetto B2; sciacqua la paletta con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti B3 e B4.
- Trasferisci lo zucchero in tutti i pozzetti della fila C: con la paletta in plastica mescola bene la reazione nel pozzetto C2; sciacqua la paletta con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti C3 e C4.
ATTENZIONE: mescola piano per evitare schizzi di liquido e pulisci bene la spatola per evitare contaminazioni tra diverse reazioni.
R Osserva con attenzione cosa succede in ciascun pozzetto: riporta le tue osservazioni nel foglio risposte [2].
ALLESTIMENTO DELLA PIASTRA N 2 (analisi dei campioni raccolti)
Nel vassoietto ci sono sostanze ignote, indicate con le lettere X, Y, W, Z, raccolte in zone diverse e ben delimitate del tavolo su cui la signora stava cucinando: probabilmente alcune di queste si sono mescolate. Puoi identificare il materiale per dolci con le stesse reazioni chimiche di prima, mentre il medicinale utilizzato dal malvivente potrebbe non reagire affatto.
R Osserva con attenzione l’aspetto fisico di ciascuna sostanza: riporta le tue osservazioni nel foglio risposte [3]. Sai dire quali sostanze sono pure e quali sono miste?
Con il pennarello indelebile etichetta la piastra di reazione n.2 scrivendo a fianco dei numeri 1,2,3,4 la sigla del campione sconosciuto (X, Y, W, Z) che analizzerai in quella colonna. Segui lo schema indicato nella figura qui sotto per preparare la piastra:
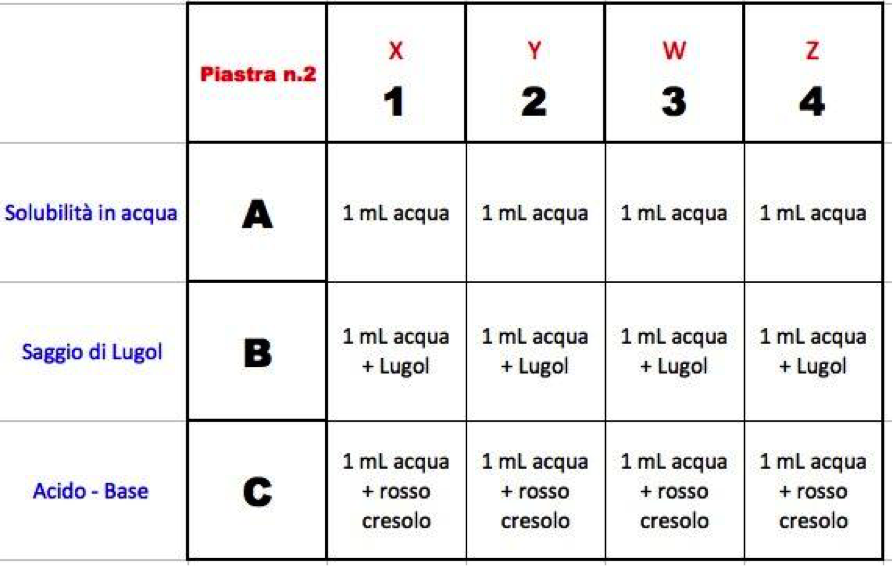
Sempre con i guanti indosso segui le istruzioni punto per punto:
- Con la pasteur H2O trasferisci 1 mL di acqua distillata in tutti i pozzetti della piastra.
- Con il dosatore contagocce aggiungi 3 gocce di Lugol in tutti i pozzetti della riga B.
- Con la pasteur Rosso aggiungi 3 gocce di rosso cresolo in tutti i pozzetti della riga C.
Mescola le soluzioni facendo ruotare delicatamente la piastra.
Analizzerai il comportamento delle sostanze ignote X, Y, W, Z rispetto a:
- Solubilità in acqua (Riga A).
- Presenza di amido, rilevabile con il saggio di Lugol (Riga B).
- Comportamento acido – base, rilevabile con l’indicatore rosso cresolo (Riga C).
Con il tappo dosatore versa la polvere in ogni pozzetto. Usa una nuova striscia per ogni sostanza.
- Trasferisci la sostanza X in tutti i pozzetti della colonna 1; con la paletta in plastica mescola bene la reazione in A1; sciacqua la paletta con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti B1 e C1.
- Trasferisci la sostanza Y in tutti i pozzetti della colonna 2:con la paletta in plastica mescola bene la reazione in A2; sciacqua la paletta con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti B2 e C2.
- Trasferisci la sostanza W in tutti i pozzetti della colonna 3:con la paletta in plastica mescola bene la reazione in A3; sciacqua la paletta con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti B3 e C3.
- Trasferisci la sostanza Z in tutti i pozzetti della colonna 4:con la paletta in plastica mescola bene la reazione in A4; sciacqua la paletta con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti B4 e C4.
ATTENZIONE: asciuga bene la paletta con la carta per evitare contaminazioni tra le diverse reazioni; mescola lentamente le reazioni per evitare schizzi di liquido.
R Osserva con attenzione e descrivi le reazioni avvenute in ogni pozzetto della piastra numero 2, contenente le sostanze ignote. Ipotizza di quali sostanze o miscugli di sostanze si tratta. C’è una sostanza che non reagisce?
ALLESTIMENTO DELLA PIASTRA N 3 (test per l’acido salicilico)
Si può rilevare la presenza di acido salicilico con il seguente test chimico:
- L’idrossido di sodio (NaOH) reagisce con l’aspirina per formare acido salicilico e acido acetico;
- Il ferro contenuto nel Fe(NO3)3 reagisce con l’acido salicilico e forma un complesso blu-violetto.
Quindi la presenza di un composto blu-violetto dopo l’aggiunta dei reagenti 4a (NaOH) e 4b [Fe(NO3)3], indica che nel pozzetto di reazione era presente l’acido salicilico derivante dall’aspirina. Per dimostrare che la sostanza ignota identificata nella piastra n.2 è veramente aspirina devi inserire nella piastra n.3:
- Un controllo positivo: serve per dimostrare che il test ha funzionato (i reagenti potrebbero aver perso di attività, oppure chi li ha preparati potrebbe aver sbagliato le dosi)
- Due controlli negativi: servono per dimostrare che il test è specifico: le sostanze per dolci trovate sul luogo del delitto non devono reagire con le soluzioni 4a e 4b.
R Quali campioni tra quelli a tua disposizione scegli per allestire la piastra n.3? Motiva la tua decisione nel foglio risposte [4].
Con il pennarello indelebile etichetta la piastra di reazione n.3 scrivendo a fianco dei numeri 1,2,3,4 le sigle del campione sconosciuto, del controllo positivo e dei due controlli negativi. Segui lo schema qui sotto:
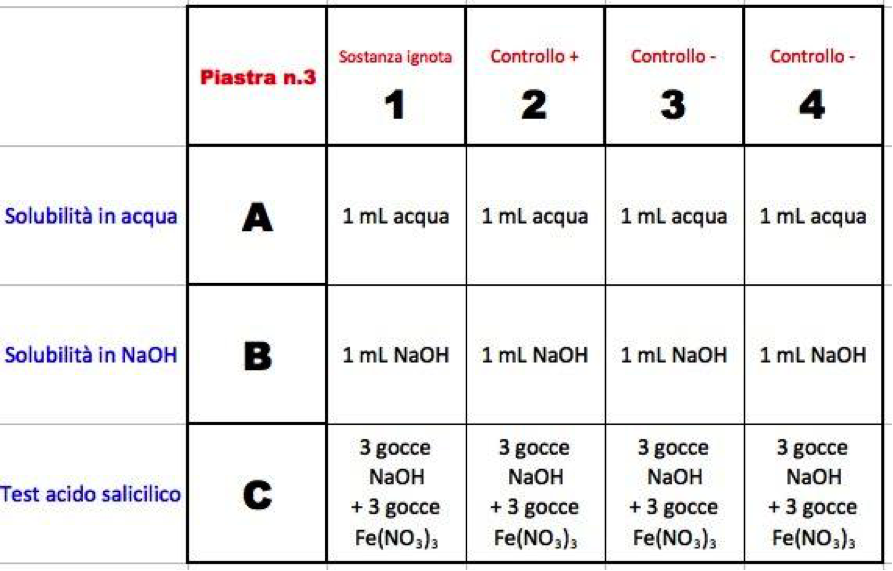
In questo caso il saggio si esegue a secco, perciò inizia versando le polveri da analizzare in tutti i pozzetti della piastra. Usa il tappo dosatore e cambia striscia per ogni sostanza:
- Pozzetti della colonna 1: sostanza ignota rinvenuta sulla scena del delitto.
- Pozzetti della colonna 2: controllo positivo.
- Pozzetti della colonna 3: primo controllo negativo.
- Pozzetti della colonna 4: secondo controllo negativo.
Prima di eseguire il test dell’acido salicilico, valuterai il grado di solubilità dei campioni in acqua e NaOH.
- Con la Pasteur H2O trasferisci 1 mL di acqua distillata in tutti i pozzetti della riga A, come mostrato in figura. Con la paletta in plastica mescola bene la reazione nel pozzetto A1; sciacqua la palettaa con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti A2, A3, A4.
- Con un’altra Pasteur marcata NaOH trasferisci 1 mL di soluzione NaOH 1M in tutti i pozzetti della riga B, come mostrato in figura. Con la paletta in plastica mescola bene la reazione nel pozzetto B1; sciacqua la paletta con acqua deionizzata, asciugala e ripeti l’operazione per i pozzetti B2, B3, B4.
R Noti differenze nella solubilità dei campioni sciolti in NaOH rispetto all’acqua? Riporta le tue osservazioni nel foglio risposte [5]
Ora sei pronto per eseguire il test dell’acido salicilico:
- Con la Pasteur NaOH aggiungi 3 gocce di soluzione NaOH 1M in tutti i pozzetti della riga C: ci vogliono almeno 10 secondi per formare acido salicilico e acido acetico.
- Con una nuova Pasteur marcata Fe aggiungi 3 gocce di soluzione Fe(NO3)3 0,2M in tutti i pozzetti della riga C: se il ferro reagisce comparirà un bel colore blu-violetto!
R Il campione ignoto è veramente aspirina? Su quali evidenze si basa la tua conclusione? Scrivilo nel foglio risposte[6]
Osservazioni e conclusioni: la signora Maria è sotto l’effetto di una dose eccessiva di aspirina? (fogliorisposte.pdf)
[1] Aspetto fisico degli ingredienti. Scrivi: Sì o No per indicare la presenza di cristalli; farinosa, media, grossolana per quantificare la granulometria che osservi
| Sostanza osservata | cristalli | granulometria |
| fecola | ||
| bicarbonato | ||
| saccarosio |
- se ti sembra solubile in acqua: ++ sciolto del tutto; + sciolto parzialmente; +/- si scioglie pochissimo e si deposita sul fondo; – non si scioglie e tende a galleggiare
- se viene colorata dallo ione triioduro I3– presente nel reattivo di Lugol : ++ colore blu scuro; – colore giallo
- se l’indicatore di pH rivela che è acido, basico o neutro (Il rosso cresolo è una molecola che cambia colore al variare del pH. E’ giallo a contatto con sostanze acide, come il succo di limone, e rosso se viene mescolato con sostanze basiche, come il sapone); + sicuramente basico; – sicuramente acido; 0 sicuramente neutro; +/-/0 se i dati non sono sufficienti per trarre conclusioni fra due delle tre alternative
| Sostanza osservata | solubile | presenza di amido | pH |
| fecola | |||
| bicarbonato | |||
| saccarosio |
- Sapresti dire per ciascun ingrediente se è fatto di molecole polari o apolari?
- Sapresti elencare qualche comune alimento che prevedi si colorerebbe di blu in presenza di Lugol?
[3] Aspetto fisico dei campioni raccolti: sapresti già dire quali sostanze sono pure e quali sono miste?
| Sostanza osservata | cristalli | granulometria | Solo osservandola si può già dire quale ingrediente sia? motiva |
| X | |||
| Y | |||
| W | |||
| Z |
Compila la tabella utilizzando lo stesso codice utilizzato prima e cerca di identificare le sostanze sconosciute, nell’ultima riga scrivi, se è possibile, da quali ingredienti è costituita.
| X | Y | W | Z | |
| Acqua distillata | ||||
| Lugol I3K | ||||
| Rosso fenolo | ||||
| Ingredienti |
La sostanza _____ non ha dato risultati significativi in seguito ai test di reazione: potrebbe trattarsi di uno dei farmaci caduti dal portapillole della signora Maria, o magari di altro ancora…
[4]
- Compila la tabella e indicando sia la sigla della sostanza, sia di che tipo di campione si tratta (sostanza ignota, controllo positivo, controllo negativo)
- Indica per ciascuna sostanza se è solubile o insolubile in acqua e in NaOH rispettivamente
++ sciolto del tutto
+ sciolto parzialmente
+/- si scioglie pochissimo e si deposita sul fondo
– non si scioglie e tende a galleggiare
- Indica anche che aspetto ha la soluzione (trasparente, torbido, gelatioso)
- Infine + per la presenza di acido salicilico nel campione – per l’assenza
| Tipo di campione | |||||
| Nome o sigla del campione | |||||
| Solubilità in acqua | |||||
| Solubilità in NaOH | |||||
| Presenza di acido salicilico |
[6] Il campione ignoto è aspirina? Su quali evidenze si basa la tua conclusione? Spiegalo interpretando il risultato anche alla luce dei controlli sperimentali
Ecco come dovrebbe apparire il vostro esperimento
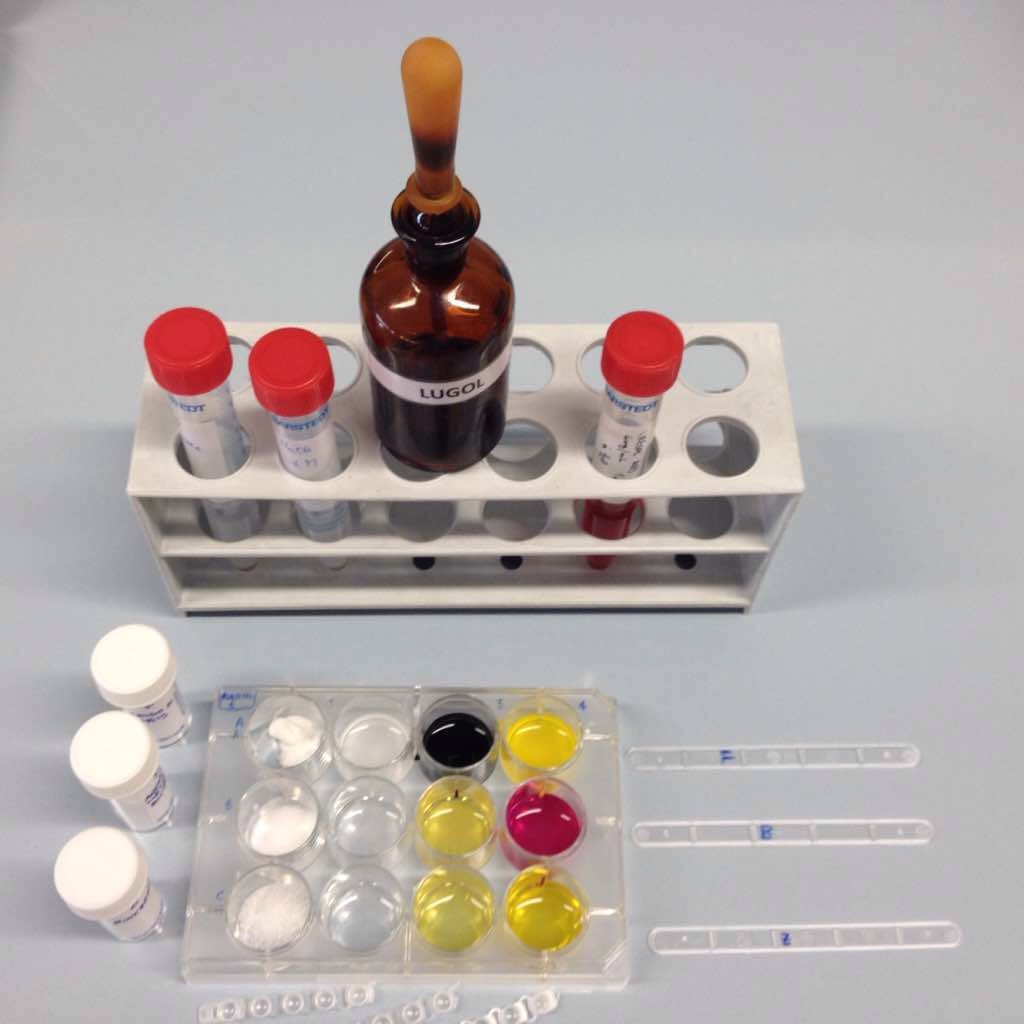
Piastra n1: controllo
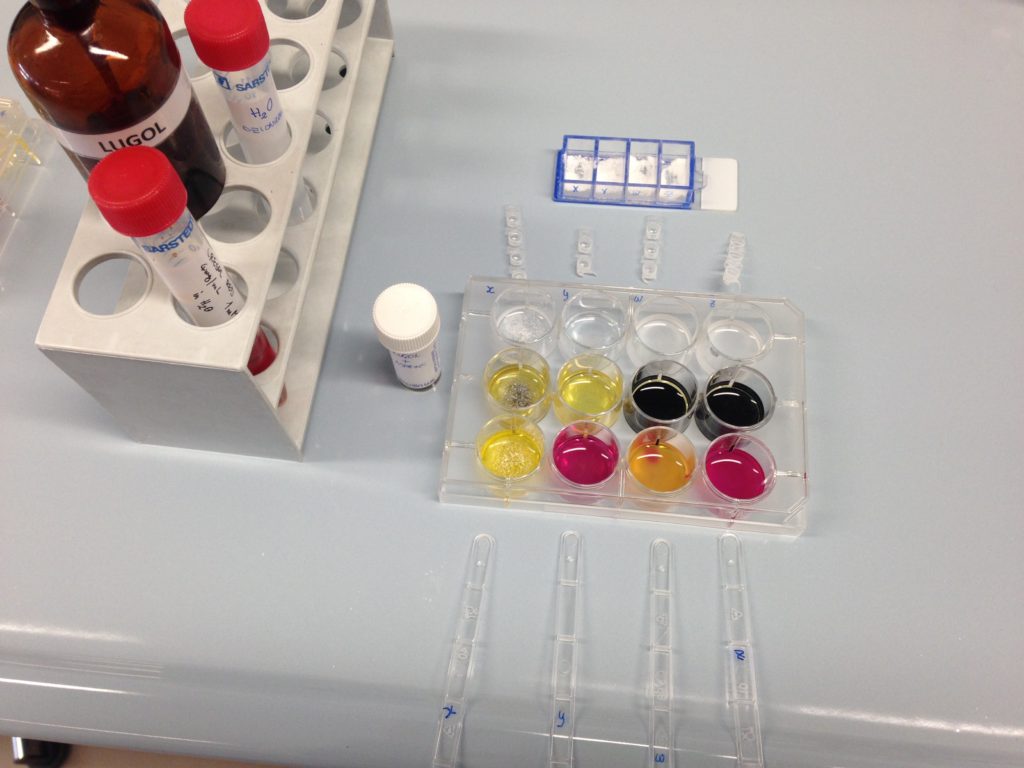
Piastra n2: determinazione del contenuto delle polveri raccolte
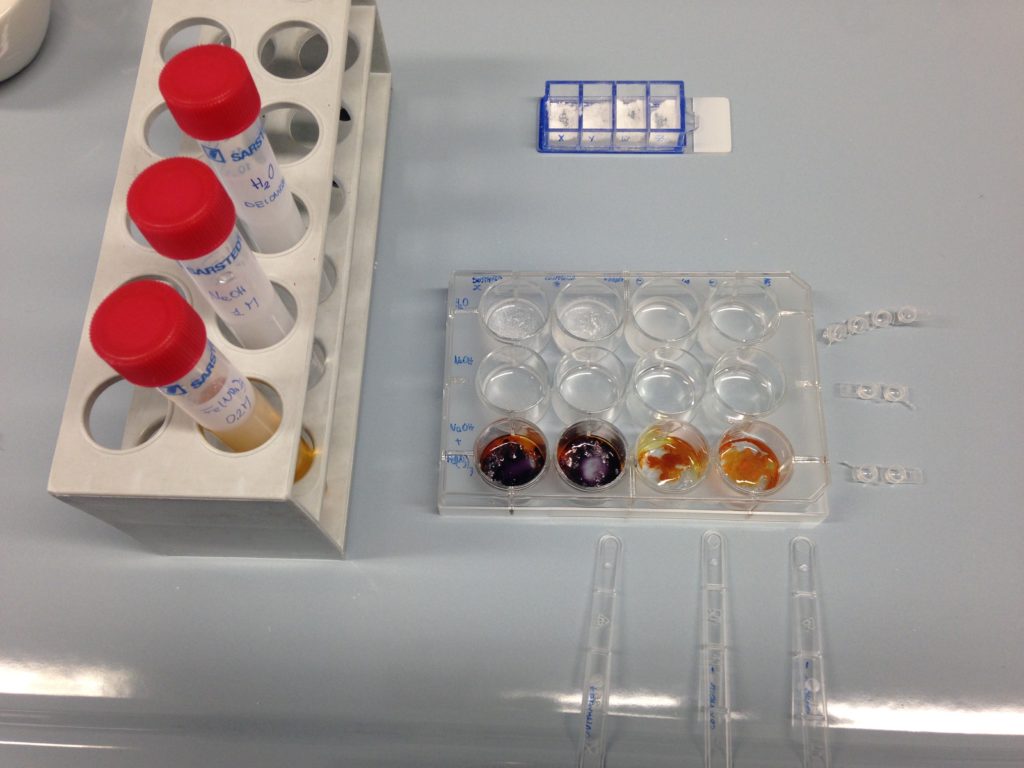
Piastra n3: test per l’acido salicilico
Ma quanto ci costa?
Un kit completo per fare un’esperienza molto simile a quella presentata qui è venduto da “Science Buddies” ed è distribuito al momento solo negli Stati Uniti al costo di circa 45 dollari. Ogni kit è sufficiente per un esperimento da ripetere 3 volte.
Tutto il materiale per organizzare l’esperimento in casa invece ha questi costi approssimativi per 10 gruppi di studenti che lavorano contemporaneamente e per molteplici riutilizzi:
consumabili (ovvero la plasticheria più o meno usa e getta):
30 piastre multipozzetto in plastica (se lavate dopo l’uso possono essere riciclate più volte)
un pacco di tubi in plastica da 50 ml; un pacco di tubi in plastica da 15 ml (usa e getta)
tubini in plastica per le varie sostanze solide (se lavati possono essere riciclati più volte)
pipette tipo pasteur in plastica (usa e getta)
palette in plastica per mescolare il caffè;
totale circa 100 euro
reagenti
aspirina generico; fecola; zucchero; bicarbonato; sono acquistabili al supermercato per un totale di una decina di euro e sono sufficienti per moltissime esercitazioni
se non sono disponibili nel laboratorio della scuola: Nitrato Ferrico (Sigma ~70 euro); NaOH (Sigma ~40 euro);Inidicatore di pH (Sigma ~25 euro) -> tutti questi reagenti sono in larghissimo eccesso rispetto alle quantità che vengono utilizzate in una esercitazione.
Chi dobbiamo ringraziare per questa attività:
l’attività è tratta con alcune modifiche e adattamenti da “Science Buddies“. A questo link trovate la descrizione dell’attività ideata dalla società Americana, le referenze, le informazioni complementari e anche un kit acquistabile online che fornisce tutto il materiale per condurre l’esperienza.
I giovani che hanno già sperimentato questa attività:
Questa attività, così come è descritta in questo blog è stata utilizzata durante la finale nazionale italiana delle Olimpiadi Europee della Scienza EUSO 2017 come parte del complesso di esperimenti che hanno portato ciascun gruppo di sfidanti alla risoluzione di un misterioso delitto (cliccate qui per saperne di più). L’attività è stata anche proposta agli studenti dell‘Istituto Scalcerle di Padova come attività pomeridiana di potenziamento. Per gli studenti che abbiamo osservato, questo esperimento ha rappresentato una sfida, ma tutti sono arrivati fino in fondo e con risultati da buoni a ottimi. Inoltre i ragazzi che lo hanno affrontato durante il potenziamento lo hanno giudicato divertente e curioso.